ステミラック注(すてみらっくちゅう)は、ニプロと札幌医科大学が共同で開発した脊髄損傷の治療薬のこと。脊髄損傷への再生医療製品の販売承認としては世界初となる。
概要
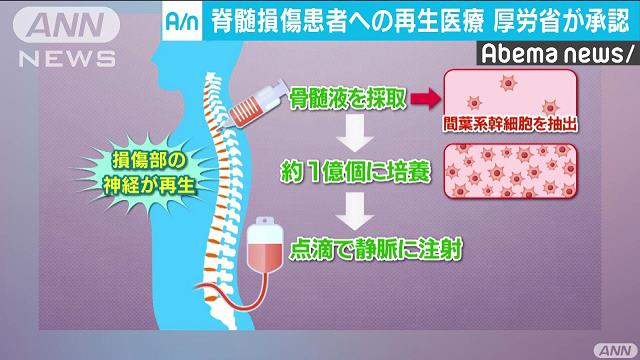
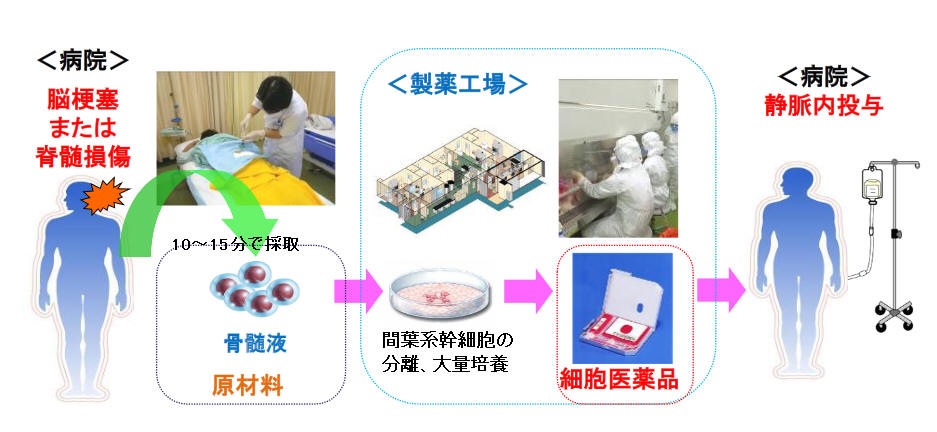
患者自身の骨髄液から、神経や血管などに分化する能力を持つ間葉系幹細胞を採取。この細胞を約1万倍に増殖させ、5千万~2億個の幹細胞を生理食塩液で3倍以上に希釈しながら点滴注射する。投与は1回。対象は受傷後31日を目安に骨髄液採取の実施が可能な患者で、慢性的な患者への有効性は確認されていない。
歴史
- 2013年
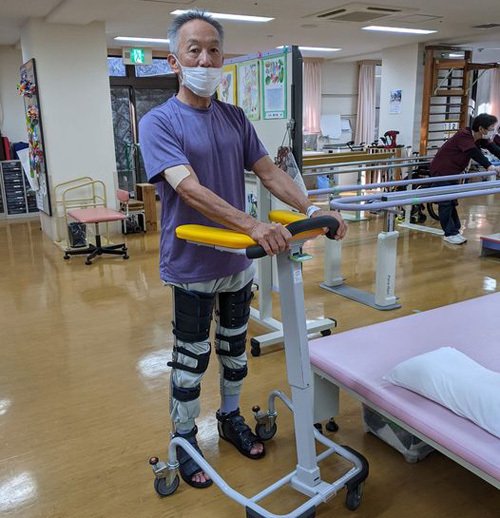
- 12月、札幌医科大学で治験開始。13人の患者が対象で13人中12人に身体の感覚が戻ったり手足が動いたりするなど目に見える効果が見られ、安全性も確認され、有意な副作用もなかった。
- 2016年
- 2月、「先駆け審査指定制度」の対象に指定される。
- 2018年
- 11月22日、厚生労働省の再生医療製品を審議する部会がニプロと札幌医科大学が開発した脊髄を損傷した患者の骨髄液から「間葉系幹細胞」を採取し、点滴で戻す「ステミラック注」の製造を承認した。治療の対象は自力で歩けないなど比較的重症の患者で、損傷から1カ月以内に骨髄を採取し、失われた感覚や運動機能の改善が期待されるとされる。
- 11月、札幌医科大学で慢性期患者対象の治験開始。
- 2019年
- 2月20日、中央社会保険医療協議会総会で、ヒト細胞加工製品(ヒト体性幹細胞加工製品)として「ステミラック注」の2019年2月26日付けで薬価基準収載が決定した。対象は、外傷性脊髄損傷で、ASIA機能障害尺度がA、B、又はCの患者に限られる。収載された薬価は、1回分14,957,755円。受注開始は2019年4月で、供給当初においては、札幌科大学附属病院のみへの提供となる。
- 5月、札幌医科大学で脊髄損傷患者の受け入れ開始。
- 9月、札幌医科大学で「ステミラック注」の実臨床での投与開始。
- 2022年
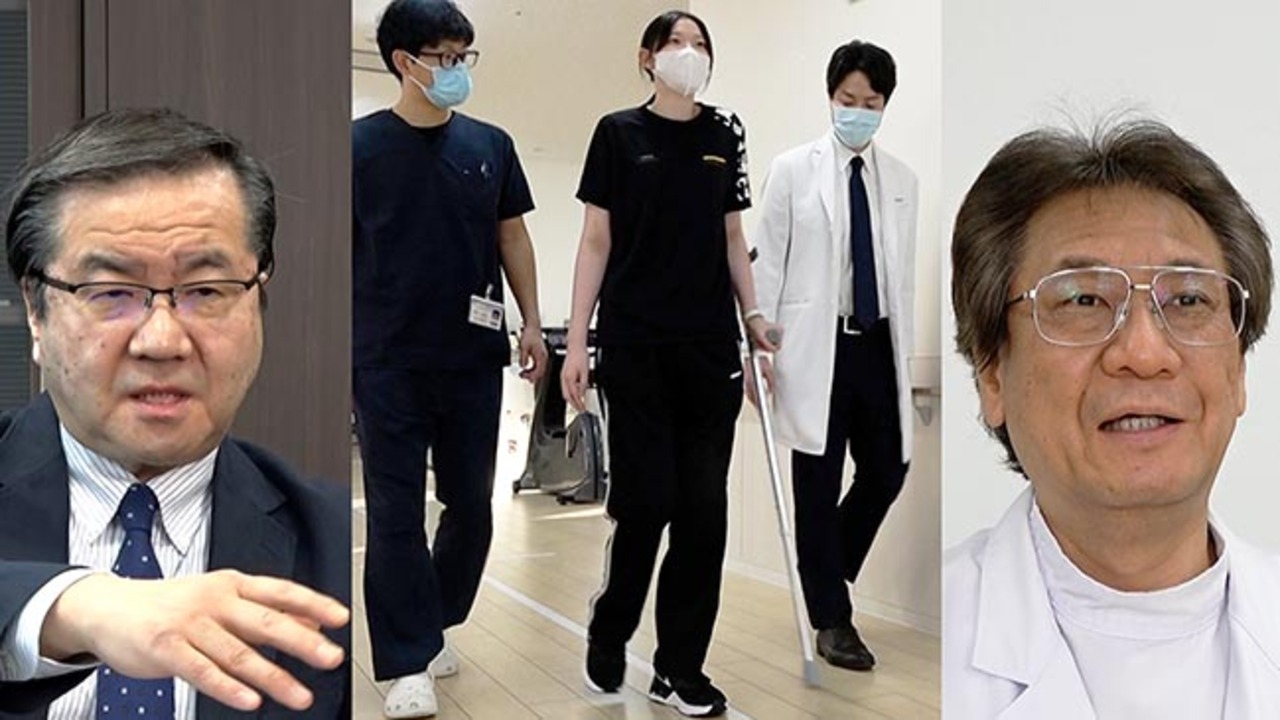
- 3月、札幌医科大学整形外科教授が、「現在までに70例以上の脊髄損傷症例に対し「ステミラック注」投与を行い、比較的良好な機能回復が得られている」とコメントをだした。
- 9月、東京労災病院が関東で初めて投与可能施設となり、「ステミラック注」の投与開始。
- 2024年
- 1月、北海道新聞により2018年末の製造販売承認から5年間で150人が保険診療を受けたと報道された。
批判
2019年1月、イギリスの科学雑誌「ネイチャー」が、「投与群と非投与群の患者を比較して治療効果を科学的に評価するランダム化比較試験が実施されていない」、「静脈注射によって全身投与された間葉系幹細胞が脊髄の再生に繋がるという仮説自体が、今までのエビデンスに反している」などの点を指摘し、日本はより透明性の高いシステムを導入すべきだと批判した。
脚注
関連項目
- 脊髄損傷